Progrediente fibrosierende interstitielle Lungenerkrankungen (ILDs)
Interstitielle Lungenerkrankungen (ILDs) umfassen eine heterogene Gruppe verschiedener Erkrankungen des Lungengewebes.1 Dabei stellt die idiopathische Lungenfibrose (medizinische Abkürzung: IPF) den Prototypen der Subgruppe der progredient-fibrosierenden ILD (PPF; progrediente pulmonale Fibrose; früher unter dem Terminus PF-ILD subsumiert) dar.1, 2
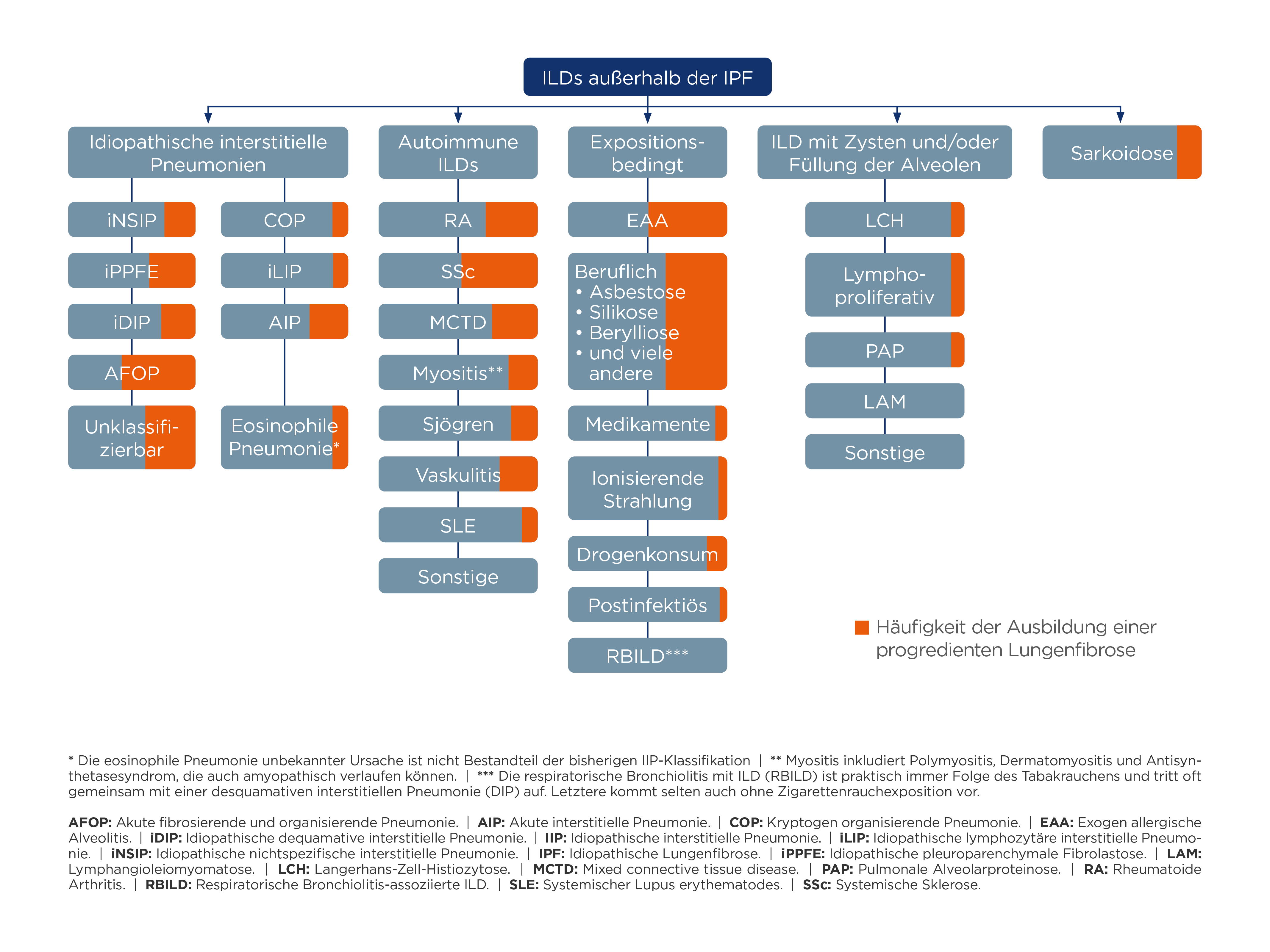
IPF wird in den internationalen Guidelines separat von der Subgruppe der PPF abgehandelt.2 Ein Teil der ILD-Patient:innen entwickelt ebenfalls im Verlauf eine PPF.1-3 Dazu zählen unter anderem bestimmte autoimmunbedingte ILDs wie rheumatoide Arthritis (RA)-, systemische Sklerose (SSc)- oder gemischte Kollagenosen (mCTD)-ILDs, bestimmte expositionsbedingte ILDs wie exogen-allergische Alveolitis (EAA), idiopathische interstitielle Pneumonien wie die idiopathische nicht-spezifische interstitielle Pneumonie (iNSIP), Sarkoidose und bestimmte ILDs mit Zysten und/oder Füllung der Alveolen. Abbildung 1 gibt einen Überblick über die verschiedenen Gruppen an ILDs und dem Risiko für die Entwicklung einer PPF. Gemeinsam ist allen Erkrankungsbildern die Pathophysiologie, bei der es zu einem Umbau des Lungengewebes mit zunehmender Vernarbung der Lunge im Sinn einer zunehmenden Fibrosierung kommt. Strukturell erfolgt ein Umbau des funktionstüchtigen Lungengewebes zu funktionsuntüchtigem Bindegewebe.2
Abb.1: Interstitielle Lungenerkrankungen (ILD) außerhalb von idiopathischer pulmonaler Fibrose (IPF) (nach 2)
IPF
Die IPF ist – wie sich aus dem Namen ableiten lässt - eine chronisch-fibrosierende interstitielle Pneumonie idiopathischer Genese. Sie weist die radiologischen und histologischen Merkmale einer UIP (Usual Interstitial Pneumonia) auf. Zu den Risikofaktoren zählen: höheres Alter (6. Und 7. Lebensdekade), männliches Geschlecht, und Rauchen (bei Diagnose sind nur mehr bis zu ca. 7% aktive Raucher). Weitere Risikofaktoren sind gastroösophagealer Reflux, Umweltbelastungen einschließlich eingeatmeter Stäube und genetische Prädisposition (< 5%).4
Die IPF geht aufgrund ihres progredienten Verlaufs mit einer schlechten Prognose einher:2 Unbehandelt ist die mediane Lebenserwartung nach Diagnose 2-5 Jahre.5
Diagnose & Therapieinitiierung:
Eine umfassende Anamnese und körperliche Untersuchung sind unerlässlich. Die häufigsten Symptome umfassen Belastungsdyspnoe, trockenen Husten, inspiratorisches Knisterrasseln in den basalen Lungenabschnitten bei der Auskultation. Bei 25-50% der Patient:innen sind Trommelschlegelfinger und/oder Uhrglasnägel ein diagnostischer Hinweis für das Vorliegen einer IPF.4, 6 In der HRCT (High Resolution Computed Tomography) ist der Nachweis eines UIP-Musters (retikuläre Veränderungen, Honigwaben +/- Traktrionsbronchiektasien) bzw. eines wahrscheinlichen UIP-Musters (keine Honigwaben; aber Retikulationen und periphere Traktionsbronchiektasien) wegweisend. Die Initiierung einer antifibrotischen Therapie sollte unmittelbar bei Diagnosestellung einer IPF erfolgen.2, 4
Eine Progression ist in den HRCT-Bildern üblicherweise durch eine Vergrößerung des Ausmaßes des UIP-Musters erkennbar. Zusätzlich nimmt das Honeycombing häufig im Zuge einer Progression zu.2
Die folgenden Kriterien gelten als Goldstandard in den aktuellen IPF-Guidelines:2, 4
Frühzeitige Diagnosestellung
Interdisziplinäre Diskussion (Pulmologie, Rheumatologie, Radiologie, Pathologie)
Antifibrotische Therapie ab Diagnose
ILD außerhalb von IPF
Davon abgegrenzt werden ILD „außerhalb der IPF“, die in die Subgruppen idiopathische interstitielle Pneumonien, autoimmune ILD, expositionsbedingte ILD, ILD mit Zysten und/oder Füllung der Alveolen und Sarkoidose unterteilt werden. Um als PPF eingestuft zu werden, müssen mindestens zwei der folgenden drei Kriterien innerhalb des vergangenen Jahres aufgetreten sein:
1.) Symptome: Verschlechterung der respiratorischen Symptome
2.) Lungenfunktion: Physiologischer Nachweis einer Krankheitsprogression
3.) HRCT: Radiologischer Nachweis einer Krankheitsprogression im Sinne des Nachweises von einem von fünf vordefinierten charakteristischen Zeichen in der HRCT
Abb 2.: Progrediente pulmonale Fibrose (PPF) Definition: mindestens 2 der folgenden 3 Progressionskriterien innerhalb 1 Jahres (nach 2)
Im Gegensatz zur IPF ist das Muster bei einer Progression variabel und es kann zu einer Umwandlung von Milchglasveränderungen zu retikulären Anomalien kommen. Unterschieden wird zwischen dem Vorliegen eines UIP-Musters, und dem NSIP (Non specific Interstitial Pneumonia)-Muster, wobei das UIP-Muster mit einer schlechteren Prognose einhergeht.2
Diagnose:
Aufgrund der Tatsache, dass Lungenfibrosen nicht heilbar sind und der Verlauf nicht vorhersehbar ist, ist es essenziell, dass die Diagnose so bald wie möglichst gestellt wird. 4, 7, 8 Auf diese Weise kann frühzeitig auch eine antifibrotische Therapie initiiert werden, mit der nachweislich dem mit der Erkrankung einhergehenden FVC (forcierte Vitalkapazität)-Abfall entgegengewirkt werden kann. (3-8) Sowohl für die Diagnose als auch für das Monitoring im Verlauf wird die Diskussion der Befunde und der Therapie in einem multidisziplinären Team empfohlen. Dieses setzt sich basismäßig aus einer:m Fachärztin:arzt aus der Pulmologie, Rheumatologie, Radiologie und ggf. Pathologie und Dermatologie zusammen. Die Expertise der:des Rheumatolog:in ist vor allem unverzichtbar bei Verdacht auf das Vorliegen einer autoimmun- assoziierten ILD wie z. B. SSc, die häufig auch als Sklerodermie bezeichnet wird.
Symptome:
Hinweise/Anzeichen für eine Lungenfibrose können sein:6
- trockener Husten
- chronische Belastungsdyspnoe
- inspiratorisches Knisterrasseln in den basalen Lungenabschnitten
Für die radiologische Diagnose von IPF bzw. PPF inkl. SSc gilt die Durchführung einer HRCT-Untersuchung als Goldstandard. Weiterführende Informationen zu Diagnose und Therapie finden sich in den entsprechenden Leitlinien2, 7 bzw. für SSc in einem Consensus-Statement9. Für RA-ILD haben österreichische Expert:innen ein Consensus-Statement zu Screening und Diagnose einer ILD bei RA entwickelt, in dem ebenfalls darauf hingewiesen wird, dass neben der Behandlung der Grunderkrankung bei Vorliegen einer progressiven Lungenfibrose rasch eine antifibrotische Therapie initiiert werden soll. Bei Patient:innen mit respiratorischen Symptomen und/oder dem Vorliegen anerkannter Risikofaktoren wird die HRCT-Untersuchung ohne Kontrastmittel als Untersuchung der Wahl empfohlen. Das Patient:innen-Gespräch ist ein zentrales Thema in dem RA-ILD Consensus Statement.10
Systemische Sklerose (SSc; Sklerodermie)
Die SSc weist von allen SARD (systemische autoimmune rheumatische Erkrankungen) die höchste Prävalenz (bis zu 80%) für eine Lungenbeteiligung in Form einer ILD auf.11 Bei erstmaliger Untersuchung mittels HRCT wird bei 50% der SSc-Patienten eine ILD detektiert.16 Eine Organbeteiligung stellt bei SSc häufig eine Todesursache dar, wobei die Lebenserwartung von Ausmaß und Schwere der Organbeteiligung beeinflusst wird.13, 14 Aus einem Literatur-Review geht hervor, dass eine Lungenbeteiligung einen relevanten prognostischen Faktor in Bezug auf die Lebenserwartung bei SSc darstellt: Gegenüber SSc-Patienten ohne konkomitante ILD, die eine 5-Jahres-Überlebensrate von 90% aufweisen, liegt jene von Patienten SSc-ILD-Patienten mit 70% darunter.14 Auch für die Art der bei SSc nachgewiesenen Autoantikörper wurde eine Korrelation mit der Lebenserwartung festgestellt: Während bei Vorliegen von Antizentromer-Antikörpern mit einer 10-Jahres-Überlebensrats von 93% zu rechnen ist, liegt diese bei Nachweis von Anti-Scl-70- und Anti-RNA-Polymerase-Antikörpern nur bei 66 bzw. 30%.13
Bei den Subentitäten wird zwischen einer diffusen kutanen SSc (dcScc) und einer limitierten kutanen SSc (lScc) unterschieden9. Die Lebenserwartung steht in Abhängigkeit von der Subentität: Während 92% der Patienten mit lcScc 10 Jahre nach Diagnosestellung noch am Leben sind, trifft dies nur auf 65% der Patienten mit dcScc zu.
Die SSc ist eine Multiorganerkrankung, die mit einer Fibrosierung des Bindegewebes einhergeht und alle Organe betreffen kann. So entwickeln die Patienten u. a. durch den fibrotischen Umbau des Bindegewebes auch Verhärtungen an der Haut, eine der prädominanten klinischen Merkmale bei SSc, die mit hohen funktionellen und psychosozialen Beeinträchtigungen einhergeht. Das Ausmaß der Hautmanifestationen wird üblicherweise mit dem modifizierten Rodnan Skin Score erfasst, bei dem die Dicke der Haut an 17 anatomischen Lokalisationen auf einer Skala von 0-3 eingestuft wird. Die Behandlung bei SSc umfasst organgerichtete Therapien und Immunsuppressiva.15 Bei einer Lungenbeteiligung in Form einer ILD ist zusätzlich eine antifibrotische Therapie indiziert. Auf alle Fälle sind eine frühe Diagnose, die Einstufung der Schwere, Prädiktion der Progressionswahrscheinlichkeit (Verlauf), eine adäquate Therapie bei SSc-assoziierter ILD sowie ein regelmäßiges Monitoring essenziell, um die besten Outcomes zu erzielen. Hoffman-Vold et al., empfehlen in den 2020 publiziertem Consensus Statement, dass jede:r Patient:in bei Diagnose einer SSc einem Screening auf ILD mittels HRCT zugeführt werden soll. Um die Schwere der SSc einstufen zu können, sollten zusätzlich noch FVC und DLCO (Diffusionskapazität von Kohlenmonoxid) in Ruhe und bei Belastung untere Miteinbezug von Symptomen und Lebensqualität bestimmt werden. In weiterer Folge sollte die Frequenz des Screenings im Rahmen des Monitorings für ILD von den Risiken für die Entwicklung einer ILD in Zusammenschau mit der Lungenfunktion und entsprechenden Symptomen gelenkt werden.9
Akute Exazerbationen
Akute Exazerbationen können bei allen Formen der ILD inklusive bei IPF jederzeit im Krankheitsverlauf auftreten.16 Ihr Auftreten bei progressiv-fibrosierenden ILD ist lebensbedrohlich und geht mit einer Erhöhung des Mortalitätsrisikos einher: Die 90-Tages-Mortalität nach einer akuten Exazerbation liegt bei ILD bei 47% und bei PPF bei 38%.17
MPR-AT-100553
Referenzen:
-
Cottin V et al., Eur Resp Rev 2018; doi: 10.1183/16000617.0076-2018.
-
Rhagu G et al., Am J Respir Crit Care Med 2022; 205: e18–e47.
-
Flaherty KR et al., N Engl J Med 2019; 381: 1718-27.
-
Behr J et al., Pneumologie 2020; 74: 263–93.
-
Kim DS et al., Proc Am Thorac Soc 2006 ;3: 285-92.
-
Borchert AT et al., Clin Rev Allergy Immunol 2011; 40: 117-34.
-
Raghu G et al., Am J Respir Crit Care Med 2018; 198: e44–e68.
-
Richeldi L et al., N Engl J Med 2014; 370: 2071–82.
-
Hoffmann-Vold A-M et al., Lancet Rheumatol 2020; 2: e71-83.
-
Hackner K et al., Z Rheumatol 2024; https://doi.org/10.1007/s00393-023-01464-w.
-
2023 ACR-Guideline for the Treatment of Interstitial Lung Disease in People with Systemic Autoimmune Rheumatic Disease; https://rheumatology.org/interstitial-lungdisease-guideline.
-
Fischer A et al., Arthritis Rheumatol 2019; 71: 182–89.
-
Odonwodo A et al., In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024. PMID: 30726020.
-
Poudel DR, Derk CT., Curr Opin Rheumatol 2018; 30: 588-93.
-
Pope JE et al., Nat Rev Rheumatol 2023; 19: 212-26.
-
Kolb M et al., Eur Respir Rev 2018; 27: 180071.
-
Suzuki A et al., Respirology 2020; 25: 525–34.